鹽酸莫西沙星為第四代新型喹諾酮類抗菌藥物,具 有廣譜抗菌活性,抗菌的作用機制為抑制拓撲異構酶Ⅱ 和拓撲異構酶Ⅳ,阻斷細菌 DNA 合成,主要優勢是耐 藥性極低,為 1.8×10-9~1×10-11,特別是不易與其他喹諾 酮類抗生素產生交叉耐藥。與第三代喹諾酮類藥物相比, 它進一步提高了對革蘭陽性菌如肺炎球菌的抑制活性, 同時也可以有效抑制厭氧菌。抗非發酵菌(假單胞菌屬 和洋蔥伯克霍爾德菌(Burkholderia cepacia)除外)、葡 萄球菌、肺炎鏈球菌、腸球菌和厭氧菌的活性是環丙沙 星和氧氟沙星的 2~16 倍 ;抗大腸埃希菌的活性是環丙沙星的 50%,而抗沙眼衣原體、肺炎衣原體和支原體的活 性都比環丙沙星高。鹽酸莫西沙星開發的制劑包括片 劑,滴眼液,注射液,療效顯著。
于鹽酸莫西沙星自身的抗菌活性,常規檢測方法 未必能真實反映其原料藥中的微生物負載,但藥品微生 物限度是藥品安全性的重要指標之一,法規文件也對此 提出了明確要求。所以,進行微生物限度檢查時,要 求供試品自身在試驗的條件下能有效排除其抑菌作用, 使其不干擾染菌的限度檢驗,檢測方法通過驗證可以確 認供試品所采用的檢查方法和檢驗條件適用。
為消除鹽酸莫西沙星的抑菌活性,準確檢測出每克 原料實際微生物負載量,本研究確認培養基適用性之后, 采用薄膜過濾法,選擇氯化鎂溶液作為中和劑,并以聚 山梨酯 80 作為中和劑同時比較,旨在驗證該方法適用于 鹽酸莫西沙星原料藥中微生物限度的檢測。
實驗所用菌株為即用型定量菌株,金黃色葡萄 球 菌 CMCC(B)26003(批號 20181008);枯 草 芽 胞 桿 菌 CMCC(B)63501(批號 20180908);銅 綠 假 單 胞 菌 CMCC(B) 10104(批號 20180809);白 色 假 絲 酵 母 CMCC(F) 98001(批號 20180904);黑 曲 霉 CMCC(F) 98003(批號 20180817)。以上菌株均為 3 代,全部購 自浙江泰林生物技術股份有限公司。其凍干粉直接用商 品配套溶液復溶,配制成菌懸液濃度為每 0.1 ml 不超過 100 cfu。 胰酪大豆胨瓊脂培養基(批號 20181025)和沙氏葡 萄糖瓊脂培養基(批號 20170837),均購自浙江泰林生 物技術股份有限公司 ;胰酪大豆胨瓊脂對照培養基(批 號 135025-201603)和沙氏葡萄糖瓊脂對照培養基(批 號 135013-201502),購自中國食品藥品檢定研究院。
鹽酸莫西沙星原料(印度瑞迪實驗制藥股份有限公 司,批號 ABKH005846),氯化鎂(國藥集團化學試劑 有限公司,批號 20181130),pH 7.2 無菌磷酸鹽緩沖液(自 制,批號 20181127)。
BHC-1300IIA2 生物安全柜(蘇州時金凈化設備科 技有限公司);生化培養箱(上海精宏實驗設備有限公司); ES-315 全自動滅菌鍋(日本 Tomy 公司);KBF220 一次 性使用集菌過濾培養器(溫州維科生物實驗設備有限公 司);XK97-A 菌落計數器(邦西儀器科技(上海)有限 公司)。
按定量菌株要求分別配制好菌懸液,使每 0.1 ml 菌 液濃度不超過 100 cfu ;按照培養基說明書要求,配制好 培養基。取金黃色葡萄球菌、銅綠假單胞菌和枯草芽胞 桿菌菌懸液各 0.1 ml,分別各注入 2 個無菌平皿中,立 即傾注胰酪大豆胨瓊脂培養基,混勻,凝固,于 30~35 ℃倒置培養 3 d。白色假絲酵母和黑曲霉同法操作菌,但于 30~35 ℃倒置培養 5 d ;同時,還將他們置于沙氏葡萄 糖瓊脂培養基 20~25 ℃培養 5 d。細菌和真菌均須用相應 的對照培養基替代被檢培養基進行上述試驗。 逐日觀察需氧菌和真菌的菌落生長情況,進行菌落 計數,取平均值計算比值。觀察比較試驗菌在被檢培養 基上與相應的對照培養基上的菌落的數量、形態和大小。
稱量鹽酸莫西沙星原料 10 g,溶于 1 000 ml pH 7.2 無菌磷酸鹽緩沖液,作為 1 ∶ 100 的供試液。 1)試驗組 取供試液 100 ml 與 0.1 ml 的金黃色葡 萄球菌的菌懸液混勻,過濾,用 700 ml pH 7.2 無菌磷酸 鹽緩沖液沖洗,每次 100 ml,沖洗 7 次 ;將濾膜取出, 菌面向上,貼于胰酪大豆胨瓊脂培養基平皿上(平行制 備 2 個平皿),于 30~35 ℃倒置培養不超過 3 d,進行菌 落計數。銅綠假單胞菌和枯草芽胞桿菌同法操作。而白 色假絲酵母和黑曲霉須同法操作各制備 2 張濾膜,分別 貼于胰酪大豆胨瓊脂培養基平皿和沙氏葡萄糖瓊脂培養 基平皿上,置于 30~35 ℃和 20~25 ℃倒置培養不超過 5 d。 2)菌液對照組 取稀釋液 100 ml 代替供試液,加 入 0.1 ml 的菌懸液(不超過 100 cfu),混勻,過濾,按 試驗組同法操作。 3)供試品對照組 取供試液 100 ml,不接入試驗菌, 按照試驗組同法操作。 4)空白對照組 用稀釋液 100 ml 代替供試液,不 接入試驗菌,按照試驗組同法操作。 試驗組菌數回收率 =(試驗組菌落數 - 供試品對照 組菌落數)/ 菌液對照組菌落數 ×100%。 上述試驗獨立平行操作 3 次。
分別以 4.0% 聚山梨酯 80 和 2 mol/L 氯化鎂為中和 劑,各組每 100 ml 培養基中加入了 5 ml 中和劑,其余 按 1.4.2 操作。
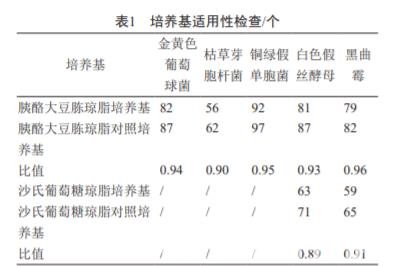
被檢與對照培養基菌落平均數的比值均在 0.5 ~ 2 范圍內,且菌落形態大小與對照培養基的菌落一致(表 1),說明培養基適用性檢查符合要求。
鹽酸莫西沙星對細菌的抑菌活性較強,檢測需氧菌 總數時需要添加合適的中和劑抑制其自身的抗菌活性 ; 白色假絲酵母和黑曲霉的回收率在 0.5 ~ 2.0 之間(表 2), 符合藥典規定要求,表明可直接進行霉菌和酵母菌的微生物限度檢測。

不同的產品,或者同一產品用途不同,微生物限度的檢測方法都存在差異,需要建立合適的方法。根 據中國藥典 2015 版通則 1105 要求,本研究首先確認 了培養基適用性,然后驗證計數方法適用性,即微生物 限度檢測方法適用性。 鹽酸莫西沙星在水中溶解度不是特別好,選擇 pH 7.2 磷酸鹽緩沖液,可以提高溶解度,并且溶液 pH 穩定。 鹽酸莫西沙星配成 1 ∶ 100 的供試液,取 100 ml,采用 薄膜過濾法,單張薄膜菌落數即可為每克原料的微生物 負載量,無需換算,符合檢測限度要求的量。 鹽酸莫西沙星屬于喹諾酮類藥物,對金黃色葡萄球 菌、銅綠假單胞菌,枯草芽胞桿菌有明顯抑制作用,未 加中和劑或加中和劑聚山梨酯 80 時,這三種細菌的回 收率均為0。